1. 錆(酸化鉄)が生まれる基本反応
鉄が錆びるとは、鉄(Fe)が酸素(O₂)や水(H₂O)と反応して酸化鉄(Fe₂O₃など)を生成する現象です。
大気中でも時間が経つと錆びますが、海水環境ではその速度が圧倒的に早まります。
2. 海水に含まれる塩分の影響
海水には 塩化ナトリウム(NaCl) が約3.5%含まれています。
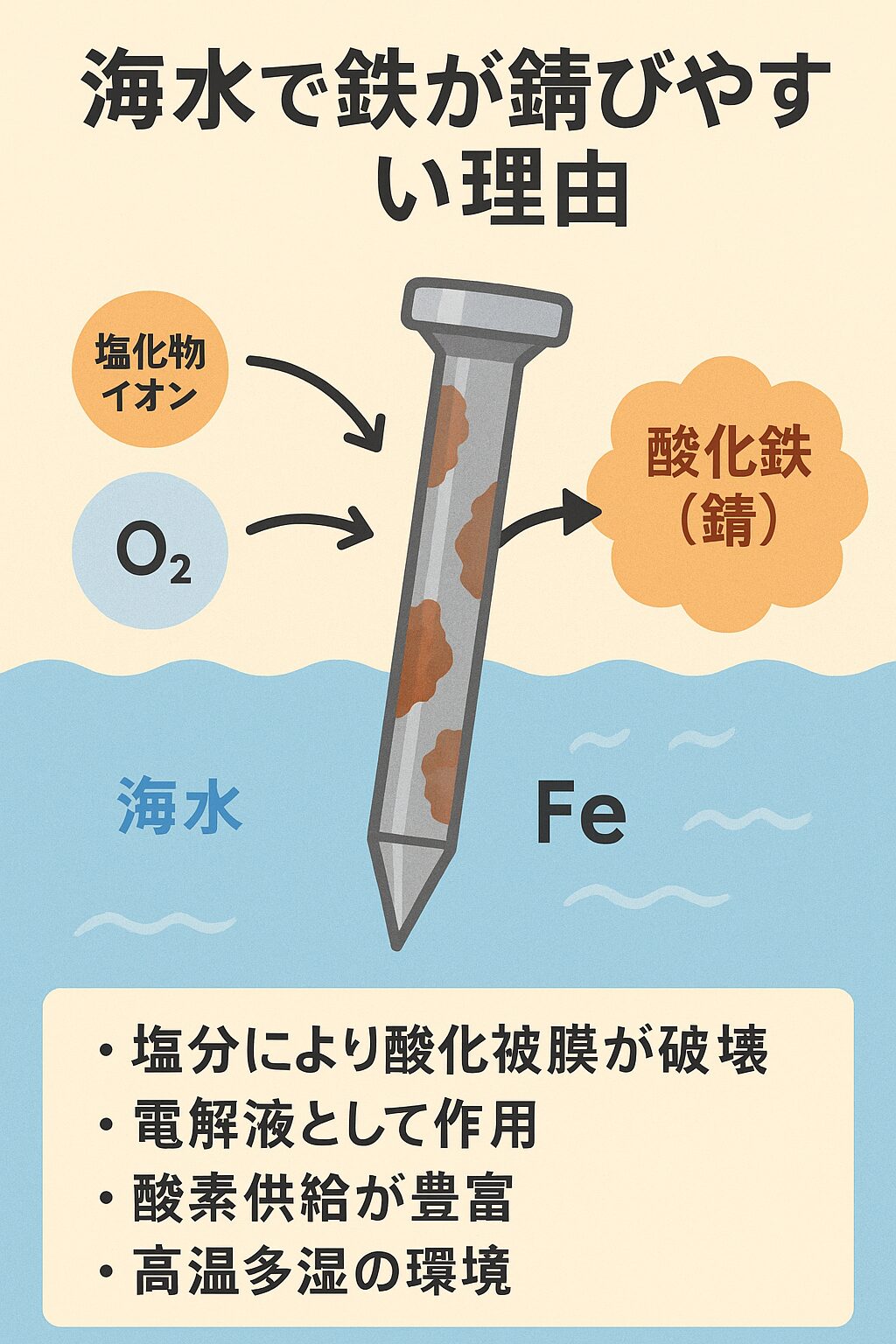
塩分は水中で Na⁺ と Cl⁻(塩化物イオン) に分かれます。
この Cl⁻イオン が鉄の錆びを加速させる最大の要因です。
・Cl⁻は鉄表面の酸化被膜を破壊し、保護膜ができにくくなる
・Cl⁻は電解質として作用し、電気を通しやすくする
つまり、鉄表面の「防錆バリア」を壊しつつ、電子のやり取りをスムーズにして錆を進行させます。
3. 電気化学的な腐食反応
海水は塩分を含むため、**電解液(電気を流しやすい水溶液)**として働きます。
その結果、鉄の表面に「微小電池(ガルバニックセル)」が形成されます。
-
アノード反応(鉄が溶ける側)
Fe → Fe²⁺ + 2e⁻ -
カソード反応(酸素が還元される側)
O₂ + 2H₂O + 4e⁻ → 4OH⁻ -
生成反応
Fe²⁺ + OH⁻ → Fe(OH)₂ → 酸化して赤錆(Fe₂O₃·nH₂O)
この「アノード」と「カソード」の反応が、海水では急速に進むのです。
4. 酸素供給の豊富さ
海水には大気から溶け込んだ酸素が含まれており、潮風や波で常に供給されます。
淡水よりも酸素供給が多いため、酸化反応が止まりにくく、錆が進行します。
5. 温度と湿度の影響
海岸は湿度が高く、さらに夏場は温度も上昇します。
化学反応は温度が高いほど加速するため、高温多湿の海辺では錆びの進行が極めて早いのです。
6. まとめ
海水で鉄が錆びやすいのは、以下の要因が重なるためです。
・塩化物イオンが酸化被膜を壊す
・電解質効果で腐食反応が進む
・酸素供給が豊富
・高温多湿の環境が反応を加速
つまり、海水は「鉄を錆びさせる理想的な条件」がすべて揃った環境なのです。